Ջրածին, ջուր և ջրածին ապագայի վառելանյութ
Ջրածինը
Ջրածինն անգույն, անհոտ, անհամ գազ է: Ամենատարածված քիմիական տարրն է Տիեզերքում. կազմում է աստղերի և Արեգակի զանգվածի մոտ կեսը, Արեգակի մթնոլորտի 84 %-ը, միջաստղային միջավայրի և միգամածությունների հիմնական մասը: Աստղերի ընդերքում ջրածնի ատոմների միջուկները վերածվում են հելիումի ատոմների միջուկների ջերմամիջուկային սինթեզ, և անջատվում է մեծ քանակությամբ էներգիա: Ջրածնի պարունակությունը երկրակեղևում 0,15 % է, ընդհանուր պարունակությունը Երկրի վրա՝ 1 %: Ջրածինը Երկրի վրա ազատ վիճակում հանդիպում է հազվադեպ՝ որոշ հրաբխային և այլ բնական գազերում, օդում՝ 10-4%: Մթնոլորտի վերին շերտերում ջրածնի պարունակությունը շատ ավելի մեծ է, մերձերկրյա տարածությունում առաջացնում է Երկրի պրոտոնային ճառագայթումային գոտին: Ջրածինը մտնում է ամենատարածված նյութի՝ ջրի 11,19% ըստ զանգվածի, ինչպես նաև քարածխի, նավթի, բնական գազերի, կենդանական ու բուսական օրգանիզմների բաղադրության մեջ:
Ջրածինը (H) պարբերական համակարգի առաջին տարրն է։ Առաջին անգամ մաքուր վիճակում ստացել է Հենրի Կավենդիշը 1766 թվականին։ Այն տիեզերքում ամենատարածված տարրն է։ Երկրի վրա այն գտնվում է հիմնականում միացությունների ձևով։ Ջրածինը միացություններում միավալենտ է։
Ջրածնի ատոմը կազմված է մեկ պրոտոն ունեցող միջուկից և մեկ էլեկտրոնից։ Հանդես է գալիս H2 պարզ նյութի ձևով։
Ջրածինը հայտնաբերվել է 16-րդ դարի կեսերին Պարացելսի կողմից, որը ստացել է երկաթի վրա ծծմբական թթու ազդելով։ 1766 թվականին Կավենդիշը հաստատել է նրա հատկությունները և ցույց է տվել նրա տարբերությունը մյուս գազերից և անվանել է «այրվող օդ»։ Լավուազիեն 1783 թվականին առաջին անգամ ջրածին ստացավ ջրից և ապացուցեց, որ ջուրը ջրածնի և թթվածնի քիմիական միացությունն է և նրան անվանեց «հիդրոգենիում», որը նշանակում է ջուր ծնող։ Ջրածինը երկրի վրա հանդես է գալիս միացություններում՝ ջրում, նավթում, կենդանի հյուսվածքներում, իսկ ազատ վիճակում՝ շատ չնչին քանակներով մթնոլորտի վերին շերտերում։
Ջրածին անջատվում է նաև հրաբխային ժայթքումների ժամանակ։ Սպեկտրոսկոպի օգնությամբ ջրածին հայտնաբերվել է արեգակի և աստղերի վրա։
Տիեզերքի նյութը ժամանակակից պատկերացումներով կազմված է 30-50%-ի չափով ազատ ջրածնից, որի ատոմը հանդիսանում է տիեզերքի կառուցման հիմնական աղյուսիկը։
Բացի ջրածնից՝ 1 ատոմական զանգվածով, հայտնի են նաև 2 և 3 ատոմական զանգվածներով ջրածիններ՝ ծանր ջրածիններ՝ դեյտերիում D և տրիտիում T, որոնք թթվածնի հետ առաջացնում են ծանր ջուր՝ (M=2Օ)։
Ստացում
Հիմնական հոդված՝ Ջրածնի արտադրություն
Ջրածնից փոքր իոնացման պոտենցիալներով մետաղների և թթուների փոխազդեցությունից (բացի HNO3 և խիտ H2SO4-ից).
Մեթանի կոնվերսիայով (փոխարկմամբ) (900°С).
Ֆիզիկական հատկություններ
Ջրածինը սովորական պայմաններում անգույն, անհամ, անհոտ գազ է։ 14,5 անգամ թեթև է օդից (ամենաթեթև գազն է)։Ջրում քիչ է լուծվում՝ 1 լ ջրում 20°С-ում լուծվում է 18 մլ ջրածին։-252,8°С-ում 1 մթնոլորտային ճնշման տակ ջրածինը դառնում է շարժուն հեղուկ, որը ևս անգույն է։
Ջրածինը լավ լուծվում է որոշ մետաղներում (Ni, Pd, Pt) 1 ծավալ պալադիումում լուծվում է 850 ծավալ ջրածին՝ տաքացնելիս այն քանակապես անջատվում է։ Ջրածնի դիրքը 1 և 7 րդ խմբում պայմանավորված է նրանով, որ ջրածնի ատոմը կարող է կորցնել էլեկտրոն նմանվելով ալկալիական մետաղներին և վերցնել էլեկտրոն նմանվելով հալոգեններին աիսպիսով ջրածնի ատոմը օժտված է վերօքս երկակիությամբ կարող է լինել և օքսիդիչ, և վերականգնիչ։
Ջրածնի ատոմը պարզագույնն է՝ բաղկացած է միջուկից և մեկ էլեկտրոնից, իոնացման պոտենցիալը՝ 13,595 Էվ, էլեկտրոնային խնամակցության էներգիան (հիմնական վիճակում գտնվող ատոմի և բացասական իոնի էներգիաների տարբերությունը)՝ 0,754 էվ։ Քվանտային մեխանիկայի օգնությամբ հաշված են ջրածնի ատոմի հնարավոր էներգետիկ վիճակները։
Այլ գազերի հետ համեմատած ջրածինն ունի ամենամեծ տեսակարար ջերմահաղորդականությունը՝ 4,12•
10−4 կալ/սմ վրկ։ Ջրածինը չափազանց դժվար հեղուկացող գազ է (կրիտիկական ջերմաստիճանը՝ -240°С)։
Հեղուկ ջրածինը թեթև (70,8 կգ/մ3, -253°С), անգույն, դյուրաշարժ հեղուկ է։
Պինդ ջրածինը բյուրեղական է, խտությունը՝ 88 կգ/մ3։ Սովորական պայմաններում ջրածնի մոլեկուլը երկատոմ է՝ Н2(ատոմների հեռավորությունը՝ 0,7414 А), դիսոցման էներգիան՝ 4,776 էվ (մոլ)։
Քիմիական հատկություններ
Ջրածնի ատոմը խիստ ռեակցիոունակ է և շատ արագ առաջացնում է H2 մոլեկուլը։ Ատոմական ջրածնով աշխատող այրիչը ստեղծում է 4000 °С բարձր ջերմաստիճան, որը պայմանավորված է H2-ի կապի մեծ էներգիայով H+H→H2ΔH=-436 կՋ է։ Բացի հիդրիդներից, որտեղ ջրածնի օքսիդացման աստիճանը -1 է, մնացած միացություններում ունի +1 օքսիդացման աստիճան։
Տաքացնելիս ջրածինը միանում է ոչ մետաղների մեծ մասի (օքսիդանում է) և ակտիվ մետաղների (վերականգնվում է) հետ, առաջացնում հիդրիդներ։ Ոչ մետաղների հիդրիդներն անգույն, սովորաբար տհաճ հոտով, թունավոր գազեր են, մետաղներինը՝ սպիտակ, բյուրեղական (իոնական) նյութեր։
Ջրածնի և հալոգենների խառնուրդները պայթուցիկ են․ ֆտորի հետ անմիջապես, քլորի հետ պայթում է լուսավորելիս, անգամ -252 °C-ում բրոմի և յոդի հետ՝ տաքացնելիս։ Առաջանում են հալոգենաջրածիններ՝ ֆաորաջրածին (HF), քլորաջրածին (НСl), բրոմաջրածին (HBr) և յոդաջրածին (HI), որոնց ջրային լուծույթներն ուժեղ թթուներ են։
Սովորական պայմաններում թթվածնի հետ ջրածինը միանում է դանդաղ, տաքացնելիս՝ պայթյունով։ Պայթուցիկ են 4-94 ծավավալ % H2 պարունակող խառնուրդները՝ թթվածնի և 4-74% Н2 պարունակող խառնուրդները օդի հետ։
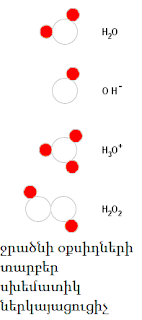
Ջրածինը թթվածնի հետ առաջացնում է նաև ջրածնի պերօքսիդ՝ H202։ Տաքացնելիս ջրածինը ծծմբի հետ միանում է հեշտությամբ, սելենի և տելուրի հետ՝ դժվարությամբ։ Առաջանում են ծծմբաջրածին՝ H2S, սելենաջրածին՝ H2Se, և տելուրաջրածին՝ H2Te, որոնք տհաճ հոտով ջրում լուծելի գազեր են (լուծույթները թթուներ են)։
Ջրածինը ազոտի հետ միանում է կատալիզատորի առկայությամբ՝ տաքացնելիս։ Ստացվում է ամոնիակ, NH3, որի ելքը մեծանում է ճնշումը բարձրացնելիս։ Ազոտի մյուս միացությունները ջրածնի հետ՝ հիդրազինը (N2H4), և ազոտաջրածնական թթուն (NH3), հեղուկներ են։
Ատոմական ջրածինը միանում է ֆոսֆորի, արսենի և անտիմոնի հետ։ Առաջանում են ֆոսֆին՝ PH3, արսին՝ AsH3, և ստիբին՝ SbH3, որոնք տհաճ հոտով, խիստ թունավոր գազեր են։
Ածխածինը ջրածնի հետ միանում է բարձր ջերմաստիճաններում՝ առաջացնելով (կատալիզատորի բացակայությամբ) մեթան՝ CH4, որը ածխաջրածինների պարզագույն ներկայացուցիչն է։ Սիլիցիումաջրածինները և բորաջրածինները՝ В2Н6,
В4Н10, В5Н9, В5Н11 և այլն, ստացվում են մագնեզիումի սիլիցիդի կամ բորիդի և թթուների փոխազդեցությամբ։ Տաքացնելիս ջրածինն իրենց օքսիդներից վերականգնում է բազմաթիվ մետաղներ (Mo, W, Cr,
Fe, Си և այլն) և ոչ մետաղներ (Сl, Տ, N, Si և այլն)։
Ածխածնի (II) օքսիդը (СО) կատալիզատորի առկայությամբ Ջրածնով վերականգնելով ստանում են օրգանական նյութեր (НСНО, СН3ОН և այլն)։
Ջրածինը միանում է չհագեցած ածխաջրածինների հետ, վերականգնում օրգանական միացությունները։ Ալկալիական, հողալկալիական և մի քանի այլ մետաղների հետ ջրածինը միանում է բարձր ջերմաստիճաններում առաջացնելով մետաղների հիդրիդներ՝ LiH, NaH,
CaH2, ВеН2 և այլն։ Այդ հիդրիդները կայուն են, հալվում են առանց քայքայվելու, ջրի առկայությամբ հիդրոլիզվում են՝ անջատելով ջրածին, ուժեղ վերականգնիչներ են։ Նրանց հալույթները էլեկտրոլիտներ են, ենթարկվում են էլեկտրոլիզի (անոդի վրա անջատվում է ջրածին)։
Ջրածինը լավ է լուծվում բազմաթիվ մետաղներում (Pd, Pt, Ni և այլն)՝ առաջացնելով ներդրման պինդ լուծույթներ։ Մետաղներում լուծվելու ունակության շնորհիվ ջրածինը․ թափանցում է մետաղների միջով (դիֆուզիա), կոռոզիայի է ենթարկում պողպատը (դեկարբոնացում)։
Ջրածինը միանում է թթվածնի հետ՝ հսկայական քանակի էներգիայի անջատմամբ ջրածնաթթվածնային բոցի ջերմաստիճանը հասնում է 3000°С։ Այս գազերի 2։1 հարաբերությունը կոչվում է շառաչող գազ, քանի որ ավարտվում է պայթյունով։
Ջրածինը ուժեղ վերականգնիչ է, այն վերականգնում է շատ մետաղներ իրենց օքսիդներից. Փոխազդում է նաև որոշ մետաղների օքսիդների հետ ստացվում է ոչ մետաղ․
Մետաղների հետ ջրածինը առաջացնում է հիդրիդներ,
որոնք պինդ նյութեր են և կարծես ջրածնի շտեմարան լինեն, որովհետև ջրի հետ՝ տալիս են
ջրածին, որը հնարավոր է ապագայում օգտագործել որպես վառելիք՝ բենզինի փոխարեն։
Օրգանական քիմիական ռեակցիաներում ջրածինը օգտագործում են հիդրացնելու համար։
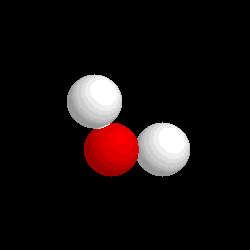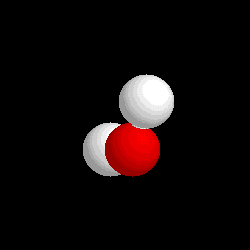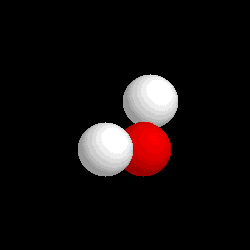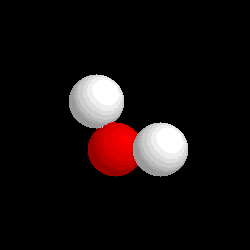
Ջուր, անօրգանական միացություն, ջրածնի օքսիդ, քիմիական բանաձևը՝ Н2O։ Ջուրը բնության ամենատարածված նյութն է, բնության մեջ հանդիպում է պինդ, հեղուկ, գազային վիճակներում։ Կազմում է կենդանի օրգանիզմների բաղադրության 2/3 մասը։
Ջրի մոլեկուլն ունի անկյունային կառուցվածք՝ HOHվիդեոանկյունը կազմում է 104.5°, բևեռային մոլեկուլ է։ OH կապը խիստ բևեռային կապ է, որի հետևանքով ջրի մոլեկուլների միջև առաջանում է ջրածնական կապ։ Ջուրը լավ լուծիչ է՝ բևեռայնության շնորհիվ։ Թթվածնի հիբրիդացումը sp3։
Ջուրը ծածկում է Երկրի մակերևույթի 2/3-ը և կենսականորեն անհրաժեշտ է կյանքի բոլոր ձևերի համար։ Երկիր մոլորակի ջրի 96.5%-ը պատկանում է օվկիանոսներին։ Երկրի ջրի միայն 2.5%-ն է քաղցրահամ, որի 98.8%-ը սառույցներ և գրունտային ջրեր են։ Ամբողջ քաղցրահամ ջրերի 0.3%-ից պակաս մասը գտնվում է գետերում, լճերում և մթնոլորտում, իսկ ավելի քիչ՝ 0,003 % քանակությունը գտնվում է կենդանի օրգանիզմներում։
Ֆիզիկական հատկություններ
Սովորական պայմաններում ջուրն անգույն, անհամ, անհոտ հեղուկ է, tհալ=0°С, tեռ=100°С, ամենամեծ խտությունը 4°С-ում է՝ ρ=1 գ/մլ։ Դրանից ցածր և բարձր ջերմաստիճաններում ρ>1։ Ջերմաստիճանից կախված խտության այս անոմալ կախվածությամբ ջուրը խիստ տարբերվում է մյուս նյութերից, որոնց խտությունը ջերմաստիճանի բարձրացումից փոքրանում է, իսկ այս դեպքում, օրինակ, սառույցի խտությունը փոքր է ջրի խտությունից, դրա համար այն լողում է ջրի վրա, դրա շնորհիվ է ձմռանը ջրի տակ կյանքը շարունակվում։ Ջուրն ունի ամենամեծ ջերմունակությունը, այդ պատճառով դանդաղ տաքանում է, դանդաղ սառչում։ Դրա միջոցով ջրավազանները կարգավորում են մեր մոլորակի ջերմաստիճանը։
Քիմիական հատկություններ
2.Փոխազդում է մետաղների հետ.
ակտիվ մետաղներ (նատրիում, կալցիում)՝
պակաս ակտիվ (ցինկ, երկաթ)՝ պասիվ մետաղների հետ
ջուրը չի
փոխազդում։
4.Փոխազդում է
թթվային օքսիդների
հետ (բացի
SiO2)
5.Հաստատուն հոսանքի
ազդեցությամբ քայքայվում
է.
6.Առաջացնում են
բյուրեղահիդրատներ
Այն միացությունները, որոնք
ջուր են
միացնում, կարող
են ծառայել
որպես չորացնող
նյութեր գազերի
համար (P2O5, CaO, BaO խոնավածուծ են։
7.Ուժեղ տաքացնելիս
փոխազդում է
ոչ մետաղների հետ.
Շատ
պինդ նյութեր ունեն ներքին կարգավորված դասավորություն։ Երբ նրանք վերածվում են հեղուկի,
այդ դասավորությունը խախտվում է, և մոլեկուլների միջև հեռավորությունը մեծանում է։
Տաքացնելիս այդ հեռավորությունն ավելի է մեծանում, մինչև, ի վերջո, մոլեկուլներն այնքան
են հեռանում, որ նյութը վերածվում է գազի։ Երբ ջուրը սառեցվում է մինչև 4 °C կամ
սառը ջուրը տաքացվում է մինչև 4 °C նրա մոլեկուլների փոխադարձ դասավորությունը
դառնում է առավել խիտ, այնպես որ նրանք զբաղեցնում են ամենափոքր ծավալը։ Այսինքն՝ այդ
ջերմաստիճանում ջուրն ունի ամենամեծ խտությունը։
Ջրածին
ապագայի վառելանյութ
Ջրածին կիրառվում է նաև օքսիդների մետաղների ստացմանհամար։ Այդ
եղանակով են ստանում դժվարահալ մետաղներ վոլֆրամը W, և մոլիբդենը՝ Mo, որոնք օգտագործվում
են էլեկտրական լամպերի շիկացման թելիկները պատրաստելու համար։ Ջրածինն օգտագործվում
է նաև բուսական յուղերից մարգարի ստանալու համար։
Ջրածնային վառելիքն էկլոգիապես անվտանգ է, այրելիս միայնջուր
է առաջանում, ուստի ջրածինն էկոլոգիապես մաքուր և իդեալական վառելանյութ է։
2H2+O2+2H20+485
կՋ
Ջրածնի այրման ջերմությունը մեկ կգ նյութի այրման ժամանականջատված
ջերմությունը մի քանի անգամ մեծ է ցանկացած այլ վառելանյութ այրման ջերմությունից։
Ջրածնի մեկ գրամի այրու միցստացվու է 120 կՋ ջերմություն, մինչդեռ նույն քանակի
բենզինի 46 կՋ։ Մյուս կողմից,
եթե ջրածնի համար, որպես հումք դիտարկենք ջուրը , ապա կհասկանանք, որ ջրածնի պաշարները
Երկրի վրա անսպառ են։ Ջրածնի ապագայի վառելանյութը էժան ջրածինն է։ Ամոնիակի սինթեզ,
քլորաջրածնի սինթեզ, հրթիռային վառելանյութ, մետաղների եռակցում, բուսական յուղ, մարգարի,
ապագայի վառելանյութ։ Ամերիկացի գիտնականները սինթեզել են հատուկ ֆերմենտ, որի ազդեցույթամբ
30% քսիլոզ պարունակող
կենսազանվածից 50oC
կարող է անջատվել անհավանական
մեծ քանակությամբ գերմաքուր ջուր է։
Ջրածին, ջուր և ջրածին ապագայի վառելանյութ
 Reviewed by Zhora aslanyan
on
March 06, 2017
Rating:
Reviewed by Zhora aslanyan
on
March 06, 2017
Rating:
 Reviewed by Zhora aslanyan
on
March 06, 2017
Rating:
Reviewed by Zhora aslanyan
on
March 06, 2017
Rating:




































No comments: